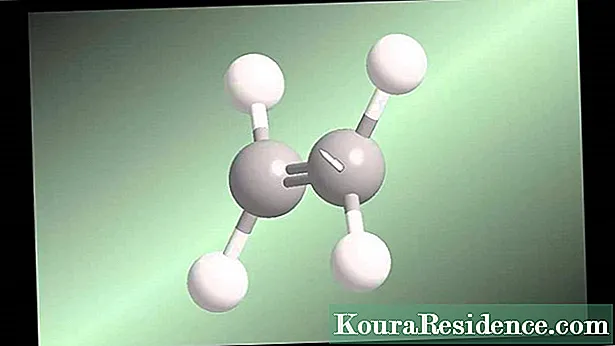
ο αλκύνια ή ακετυλενικοί υδρογονάνθρακες είναι υδρογονάνθρακες που χαρακτηρίζονται από την παρουσία τριπλού δεσμού άνθρακα-άνθρακα. Τα μη κυκλικά αλκύνια αποκρίνονται στον μοριακό τύπο CνΗ2ν-2. Έχουν ακόμη υψηλότερο βαθμό εγκατάστασης από αυτόν των αλκενίων.
Μεταξύ των χημικών ιδιοτήτων του αλκύνια τονίζει το γεγονός ότι είναι ενώσεις χαμηλής πολικότητας, Έτσι αδιάλυτο στο νερό, αλλά αρκετά διαλυτοί σε κοινούς οργανικούς διαλύτες όπως αιθέρας, βενζόλιο ή τετραχλωράνθρακας.
οσημεία βρασμού και τήξης αλκυνών είναι πολύ παρόμοια με αυτά αλκανίων ή αλκενίων ίσου αριθμού άνθρακα. Είναι πιο αισθητή, ωστόσο, η επίδραση σε αυτές τις φυσικές σταθερές που έχουν τον αριθμό των ανθράκων και την παρουσία κλαδιών στην αλυσίδα (που αλλάζουν προς την ίδια κατεύθυνση).
Το απλούστερο αλκύνιο είναι ασετυλίνη, ακολουθούν το προπυλένιο (ή συμβουλή) και το βουτίνο, που μπορεί να είναι 1-βουτύνιο (τριπλός δεσμός στο τέλος του μορίου) ή 2-βουτύνιο (τριπλός δεσμός στο κέντρο του μορίου). Αυτά τα τρία είναι αέρια; αυτά με τον υψηλότερο αριθμό ατόμων άνθρακα είναι υγρά ή στερεός.
Παρόμοια με τα αλκένια, οι τριπλοί δεσμοί που χαρακτηρίζουν τα αλκύνια τους δίνουν μεγάλη χημική αντιδραστικότητα αυτές τις ουσίες και τις καθιστούν πολύ επιρρεπείς σε αντιδράσεις προσθήκης (υδρογόνο, αλογόνα, νερό κ.λπ.) και άλλες. Ωστόσο, οι τρεις δεσμοί που ενώνουν ένα άτομο άνθρακα με ένα άλλο δεν είναι ισοδύναμοι: ένας από αυτούς (που ονομάζεται δεσμός σίγμα) είναι ισχυρότερος και ενεργεί ως ο κύριος υπεύθυνος για την ένωση. Η προκύπτουσα ένωση μπορεί να έχει διπλούς δεσμούς ή μόνο μεμονωμένους δεσμούς.
Οι ενώσεις που έχουν τον τριπλό δεσμό στο ένα άκρο της αλυσίδας καλούνται τερματικά αλκύνια; Αυτές οι ενώσεις χαρακτηρίζονται από την έντονη οξύτητά τους. Στην πραγματικότητα, τα τερματικά αλκύνια είναι οι πιο όξινοι απλοί υδρογονάνθρακες. Το μήκος μεταξύ των ατόμων άνθρακα στον δεσμό είναι 1,20 amstrongs (ακόμη μικρότερο από αυτό των αλκενίων .31,34 amstrongs─ και εκείνο των αλκανίων .51,54 amstrongs─). Ενιαίοι, διπλοί και τριπλοί δεσμοί άνθρακα-άνθρακα μπορούν να συνυπάρχουν στο ίδιο μόριο. Όταν συμβεί αυτό, ο υδρογονάνθρακας ονομάζεται αλκύνιο και η θέση του διπλού δεσμού υποδεικνύεται με τον τερματισμό "ene", εισάγοντάς τον όπου χρειάζεται
Παραδείγματα αλκυνών παρατίθενται παρακάτω:
- αιθίνη (ακετυλένιο)
- υπόδειξη
- 2- πεντίνη
- 2-βουτύνιο
- 1-βουτύνιο
- 3 Οκτωβρίου
- 2-nonino
- Μεθυλ ακετυλένιο
- Αιθυλ ακετυλένιο
- 1-ene-4-εξίνη
- Προπυλο ακετυλένιο
- Τερβουτυλο ακετυλένιο
- 6,6-διαιθυλ-4-νιινο
- 5,6-διμεθυλ-3-επτίνη
- 3,3-διαιθυλ-3,5-nonadiino
- κυκλοβουτίνη
- 3-αιθυλ-5-αιθυνυλεπτα-1,6-διινο
- 5-μεθυλ-2-εξίνη
- 3,5,7-δεκατρίνο
- 6-μεθυλ-2,4-επταδιινο